سلولهای بنیادی خاصی در صفحهی رشد استخوان شناسایی شدهاند که هم سلولهای غضروف و هم سلولهای بنیادی مغز استخوان را تولید میکنند.
رشد استخوانهای بلند در پستانداران جوان ازطریق رشد این صفحهی غضروفی (صفحهی رشد استخوان) اتفاق میافتد؛ یک منطقه از غضروف که هر انتهای استخوان را از شَفت (بدنه) جدا میکند. صفحهی رشد حاوی سه نوع سلول متمایز است. سلولهای غضروفی (کندروسیتها) گِرد، در منطقهی استراحت صفحهی رشد به کندروسیتهای مسطح تکثیرشوندهای تبدیل میشوند که ستونهایی را در طول محور طولی استخوان ایجاد میکنند. این سلولها بعدا به کندروسیتهای هایپرتروفیک تبدیل میشوند که تکثیرشان متوقف شده و با استخوان و مغز استخوان جایگزین میشوند. بنابراین کندروسیتهای صفحهی رشد باید بهطور مداوم تأمین شوند و این سلولهای بنیادی هستند که این فرایند را تغذیه میکنند.
بهتازگی، نیوتن و همکاران و قبل از آنها، میزوهاشی و همکاران، نوعی از سلولهای بنیادی اسکلتی را در منطقهی استراحت استخوانهای موش شناسایی کردهاند که تمام انواع کندروسیتهای صفحهی رشد و برخی از سلولهای بنیادی با طول عمر زیاد موجود در استرومای مغز استخوان (سلولهای غیرخونی) را تولید میکنند. هر دو گروه از پژوهشگران، سلولهای منشاءگرفته از کندروسیتها را با استفاده از نشانهگذاری فلورسنت پروتئینها، بهصورت انفرادی دنبال کردهاند. پژوهشگران سلولهای دارای تقسیم سلولی آهستهای را در منطقهی استراحت شناسایی کردند که موجب ایجاد ستونهای منوکلونالی (منشا گرفته از یک سلول) از کندروسیتهای تکثیرشونده و هایپرتروفیک در صفحهی رشد میشدند.
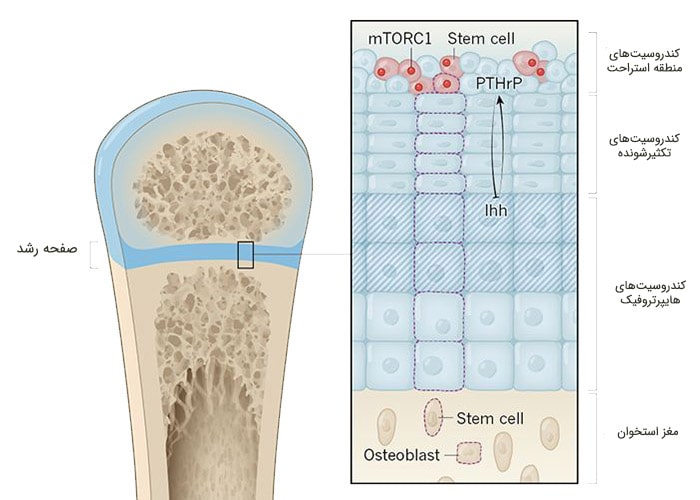
شرح تصویر: نحوهی رشد استخوانهای بلند به چه صورت است؟ صفحهی رشد که از غضروف ساخته شده، بین بدنه و انتهای استخوان قرار گرفته است (غضروف به رنگ آبی و بافت استخوانی شده به رنگ قهوهای نشان داده شده است). صفحهی رشد را میتوان به منطقهی استراحت که حاوی سلولهای غضروفی گرد (کندروسیتها) است، منطقهای که توسط ستونهایی از کندروسیتهای تکثیرشوندهی مسطح تشکیل شده و منطقه دیگری که از کندروسیتهای بزرگ (هایپرتروفیک) غیرتکثیر شونده تشکیل شده، تقسیم کرد. نیوتن و همکاران نشان دادند که منطقهی استراحت حاوی سلولهای بنیادی (قرمز) بوده که حاوی ستونهای منوکلونال از کندروسیتهای مسطح و هایپرتروفیک است که برخی از آنها تبدیل به سلولهای تشکیلدهندهی استخوان (استئوبلاستها) و برخی دیگر تبدیل به سلولهای بنیادی استرومای مغز استخوان میشوند. یکی از سلولهای بنیادی منطقهی استراحت و سلولی که از این سلول بنیادی منشا گرفته، بهصورت دور نقطهچین نشان داده شده است. مسیر سیگنالدهی کمپلکسِ یک هدف راپاماسین در پستانداران (mTORC1)، ظرفیت خوداحیایی سلولهای بنیادی منطقهی استراحت را حفظ میکند. پروتئین مرتبطبا هورمون پاراتیروئید (PTHrP) که در منطقهی استراحت تولید میشود و پروتئین Ihh که توسط کندروسیتهای هایپرتروفیکی که زودتر تمایز حاصل میکنند (سلولهایی که با هاشور نشان داده شدهاند) تولید میشود، برای تنظیم تکثیر و تمایز کندروسیتهای صفحهی رشد منطقهی استراحت با هم در تعامل هستند.
مقالههای مرتبط:
سلولهای تازهشناساییشده، دارای ویژگی سلولهای بنیادیبوده و ظرفیت تمایز به چندین نوع سلول را دارند. علاوهبراین، پژوهشگران با علامتگذاری و ردیابی این سلولها در موشهای جوان متوجه شدند که این سلولها در بزرگسالی به شکل ستونی از کندروسیتها درمیآیند. نیوتن و همکاران، چگونگی تقسیم این سلولها را نیز بررسی کردند و متوجه شدند که آنها اغلب بهصورت سلولهای ساکن و غیرفعالی هستند که گاهی اوقات یک تقسیم سلول نامتقارن را میگذارنند. حاصل این تقسیم سلولی، یک سلول خود احیاکننده و سلول دیگری که قابلیت تمایز دارد، است. این مشاهدات نشاندهندهی ویژگی بنیادی این سلولهای تازه شناسایی شده است و از این فرضیه حمایت میکند که این تقسیمهای نامتقارن، مخزن کندروسیتهای صفحهی رشد را مجددا پر میکنند.
اما تنوع سلولهای بنیادی شناساییشده در این دو مطالعه چقدر بوده است؟ نیوتن و همکاران، کندروسیتهایی که کلاژن نوع دو را بیان میکردند، علامتگذاری کردند. این سلولها به احتمال زیاد جمعیتی از سلولها هستند که PTHrP را نیز بیان میکنند.
میزوهاشی و همکاران متوجه شدند که اگرچه سلولهای بنیادی منطقهی استراحت متعلق به خط سلولی کندروسیتها هستند، ولی دارای نشانگرهای مختص سلولهای بنیادی بوده و فرایند بلوغ آنها مشابه فرایند بلوغ سلولهای بنیادی مغز استخوان است. اگرچه هنوز مکانیسمهایی که فرایندهای تمایز هر دو نوع سلول را تنظیم میکنند، کشف نشدهاند.
سلولهای بنیادی منطقهی استراحت از کجا میآیند؟ رشد استخوان در جنین مانند رشد استخوان پس از تولد، توسط تکثیر کندروسیتها و بهدنبال تمایز هایپرتروفیک و جایگزینی کندروسیتها توسط استخوان انجام میشود. این فرایند منجر به تشکیل یک بدنهی استخوانی محکم میشود که در دو انتهای آن غضروف قرار گرفته است.
نیوتن و همکاران، کندروسیتهای جنینی را علامتگذاری کردند و متوجه شدند که برخی از آنها تبدیل به سلولهای بنیادی منطقهی استراحت میشوند. این آزمایشها همچنین نشان داد که در بافت استخوانی قبل از تولد، هرکدام از ستونهایی که از کندروسیتهای تکثیرشونده و هایپرتروفیک تشکیل شدهاند (، دارای منشا چندسلولی هستند؛ برخلاف وضعیتی که درمورد رشد استخوان پس از تولد دیده میشود (که هر ستون سلولی از یک سلول انفرادی منشا میگیرد). این مشاهدات نشان میدهند که شیوهی سازماندهی رشد استخوان در هنگام جنینی و پس از تولد، یکسان نیست.
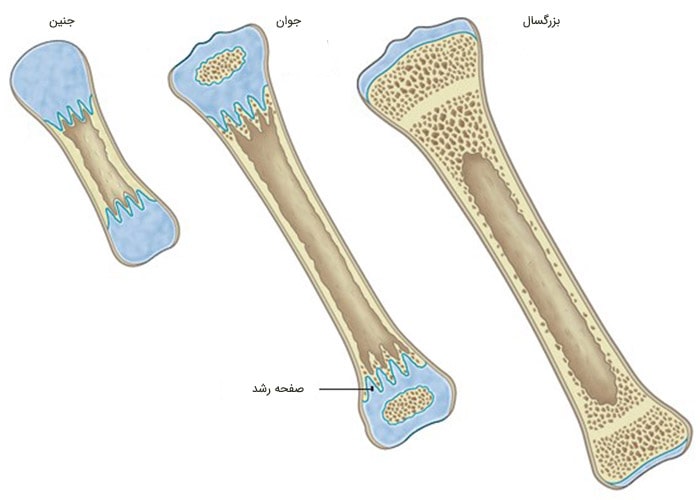
چگونه سلولهای حاصل از کندروسیتهای جنینی، ویژگی سلول بنیادی بهدست میآورند؟ هر دو مطالعه نشان میدهند که ظهور ظرفیت خوداحیاکنندگی با ایجاد مراکز استخوانسازی ثانویه (مناطقی که در آن بافت استخوان تشکیل میشود) در انتهای استخوانها بالافاصله پس از تولد، ارتباط دارد.
نیوتن و همکاران، مسیر کمپلکس یک هدف راپاماسین در پستانداران (mTORC1) را که گزارش شده بود عملکرد سلولهای بنیادی را تنظیم میکند، مورد بررسی قرار دادند. آنها دریافتند که فعالسازی این مسیر منجر به تغییر تقسیم سلولی متقارن به تقسیم سلولی نامتقارن و درنتیجه، افزایش تعداد سلولهای بنیادی در منطقهی استراحت میشود. این مشاهدات بهشدت از نقش mTORC1 در تنظیم ظرفیت خوداحیایی سلولهای بنیادی منطقهی استراحت حمایت میکند.
هر دو گروه نقش پروتئین Ihh را نیز در این زمینه مورد مطالعه قرار دادند. نشان داده شده است که در کندروسیتهای منطقهی استراحت، Ihh موجب بیان PTHrP میشود و این امر بهنوبهی خود مانع از آغاز زودهنگام هایپرتروفی در سلولهای تکثیرشونده میشود. علاوهبراین، هم Ihh و هم PTHrP موجب فعال شدن تکثیر کندروسیتها میشوند. هر دو گروه از پژوهشگران، شواهدی را ارائه دادند که نشان میدهند مهار مسیر سیگنالدهی Ihh، از طول ستونهای کندروسیتی کم میکند.
نیوتن و همکاران همچنین پس از فعالسازی مسیر Ihh، شاهد افزایش تکثیر و بیان ژنهای مورد هدف قرارگرفته توسط پروتئینهای Ihh در سلولهای منطقهی استراحت بودند. این یافتهها نشان میدهند که سیگنالدهی Ihh در کنترل ویژگی سلول بنیادی سلولهای منطقهی استراحت نقش دارد. اگرچه، باتوجهبه اینکه Ihh بهطور مستقیم بیان PTHrP را کنترل میکند، تغییرات مشاهدهشده در طول ستون کندروسیتی و تکثیر سلول نیز ممکن است پیامدی از تغییر در سطوح PTHrP باشد. علاوهبراین، زمانیکه نیوتن و همکاران، مسیر سیگنالدهی Ihh را مهار کردند و همزمان مسیر mTORC1 را فعال کردند، برخی از سلولهای بنیادی بدون تمایز به سلولهای مسطح، از منطقهی استراحت به منطقهی تکثیر رفتند.
مقالههای مرتبط:
بهطور کلی، این مشاهدات از نقش Ihh در تنظیم تکثیر سلولهای بنیادی و نه تعیین هویت سلولهای بنیادی حمایت میکند. باتوجهبه پیچیده بودن اثرات متقابل بین سیگنالدهی Ihh و PTHrP، ایجاد تمایز بین نقشهای Ihh بهعنوان تنظیمکنندهی تکثیر سلولهای بنیادی، بیان PTHrP و القا و حفظ ویژگیهای سلول بنیادی دشوار است.
طی چند سال گذشته، مدلی که برای تعریف نحوهی جایگزینی غضروف با استخوان استفاده میشد، تغییر چشمگیری پیدا کرد. قبلا تصور میشد که کندروسیتهای هایپرتروفیک میمیرند و توسط سلولهای تشکیلدهندهی استخوان به نام استئوبلاستها جایگزین میشوند. اما مطالعات اخیر نشان دادهاند که بخشی از کندروسیتهای هایپرتروفیک به استئوبلاستهای تشکیلدهندهی استخوان یا سلولهای بنیادی دارای عمر طولانی و سلولهای اجدادی استرومای مغز استخوان تمایز مییابند.
میزوهاشی و همکاران نشان میدهند سلولهایی که از تبار سلولهای بنیادی منطقهی استراحت هستند، در تشکیل استرومای مغز استخوان شرکت میکنند. بنابراین، بهنظر میرسد که این سلولهای بنیادی از یک مسیر تمایز غیرعادی عبور میکنند. آنها از سلولهای بنیادی خط سلولی کندروسیت، به کندروسیتهای تمایز یافته و پس از آن نیز به سلولهای بنیادی استرومای مغز استخوان تبدیل میشوند.
در پژوهشهای آینده باید این موضوع مشخص شود که پس از تولد، چه بخشی از سلولهای بنیادی مغز استخوان از سلولهای بنیادی منطقهی استراحت منشا میگیرند و اینکه آیا این سلولهای تشکیلشده پس از تولد، ازلحاظ عملکردی با دیگر سلولهای مغز استخوان تفاوت دارند یا خیر. باتوجهبه اینکه سلولهای بنیادی اسکلتی مشتقشده از مغز استخوان در طول زندگی هر فردی برای بازسازی استخوان و ترمیم شکستگیها لازم هستند، کشف ویژگیهای خاص جمعیتهای سلولی مشتق شده از کندروسیتها اهمیت زیادی دارد.
شناسایی سلولهای بنیادی اسکلتی اختصاصی صفحهی رشد، گام مهمی درجهت درک رشد استخوان در انسان و بیماریهای مرتبط است اما سوالات زیادی همچنان باقی میماند. در مطالعاتی که در آینده انجام میشوند، باید مشخص شود که علاوهبر مسیرهای سیگنالدهی Ihh و mTORC1، چه مکانیسمهای دیگری موجب القا و حفظ خصوصیات بنیادی این سلولها میشود، کدام نوع از کندروسیتهای جنینی به سلولهای بنیادی منطقهی استراحت تکامل مییابند و چگونه القای این فرایند با تشکیل مراکز استخوانسازی ثانویه مرتبط است.
همچنین، مطالعات بیشتری نیاز است تا مشخص شود که چگونه تمایز سلولهای بنیادی در منطقهی استراحت تنظیم میشود و کدام اجزای ماتریکس خارج سلولی اختصاصی کندروسیت (شبکهای از ملکولهای پروتئین و قند که در اطراف سلولها قرار گرفتهاند) برای تولید یک خانواده از سلولهای بنیادی نیاز هستند.
درنهایت، باتوجهبه اینکه برخی از کندروسیتهای هایپرتروفیک به استئوبلاستها و سلولهای بنیادی مغز استخوان تمایز مییابند ولی برخی دیگر میمیرند، این وسوسهانگیز است که سؤال کنیم آیا سرنوشت سلولهای هایپرتروفیک از قبل و توسط زیرمجموعههای مجزای سلولهای بنیادی منطقهی استراحتی که از آن منشا میگیرند، تعیین میشود یا خیر.
.: Weblog Themes By Pichak :.
